الأبحاث المستقبلية لعلاج تساقط الشعر
By Prof. Dr. Soner Tatlidede 2017-01-16

سوف تتغلب أدوية تساقط الشعر في المستقبل على العديد من العوائق سواء فى طرق العلاج التجميلية، الطبية الجراحية المستخدمة حالياً وسوف تتضمن بعض طرائق العلاج الجديدة كلياً مثل استنساخ بصيلات الشعر والعلاج الجيني، وكلاهما من الطرق التي لديها القدرة على "العلاج" الفعلي لنمط الصلع الوراثي بشكلٍ دائم.
لكن، من المنطقي أيضاً أن نسأل: لماذا يبذل المجتمع البشري جهوداً كبيرة على الأبحاث الطبية الحيوية بالإضافة للتكاليف الكبيرة على أدوية تساقط الشعر، في حين أن الأمراض القاتلة والفتاكة مثل الإيدز والسرطان والسكري وأمراض القلب تتطلب حلولاً أيضاً؟ في الحقيقة، تعتبر بصيلات الشعر البشري قالباً علمياً غنياً لفهم مجالات هامة لبيولوجيا الجسم البشري، على سبيل المثال الجهاز العضوي لجسمنا وانقسام الخلايا وعملية النمو ومراحله، رد فعل المناعي للجسم واستجابته وآخر شيء هو الجينوم البشري.
عند النظر لمراحل نمو الشعر، فبالإضافة لكون الشعر ينمو ويتساقط وفق هذه المراحل، فإن بصيلات الشعر تتحلل ذاتياً غالباً بشكلٍ كامل عند نهاية طور التساقط، وعلى الأغلب تتكون بصيلات شعر جديدة تماماً في بداية طور النمو التالي. إن تكون جريبات شعر جديدة في بداية كل طور نمو يظهر فرصاً فريدة لتطبيق تقنيات البيولوجيا الجزيئية الطبية المتقدمة مثل الاستنساخ، والعلاج الجيني. وكلما كشفنا عن عمل أجزاء مختلفة من جسم الإنسان، كلما وجدنا أن كل شيء مرتبط، وما نتعلمه في مجال واحد من الطب يمكن حتماً أن يطبق على العديد من المجالات الأخرى.
مستقبل العلاجات الطبية لتساقط الشعر:
تعتبر العديد من أدوية تساقط الشعر في يومنا الحالي ذات فعاليةٍ محدودة. كذلك فليس لدينا معلومات كافية لماذا تسبب العديد من الأمراض تساقط الشعر. في العديد من الحالات، نحن نعالج الأعراض، لكن لا نعالج الأمراض، وغالباً تكون قدرتنا على علاج الأعراض ذات فعالية محدودة. في الحقيقة، الأدوية التي توصف اليوم لمواجهة الصلع الأندروجيني (نمط تساقط الشعر الوراثي)، تتطلب الاستمرار في استخدامها لضمان الحصول على فوائدها، و تملك هذه الأدوية فقط تأثيراً محدوداً على بعض المرضى. كذلك فيجب تحملّ تكلفة هذه الأدوية لفترة طويلة من الحياة طالما يريد الشخص الحصول على فائدة منها. في المستقبل، سيتوصل العلماء والأطباء لفهم أفضل لكيفية ضبط دورة حياة الشعر الطبيعية، وكيف تؤثر العديد من الحالات المرضية على نمو الشعر، كذلك سيتم تطويرالأدوية الجديدة لتصبح أكثر فعالية في استهداف أسباب تساقط الشعر وكذلك سبب الآثار الجانبية.
الدوتاسترايد:
يعتبر الدوتاسترايد أحد العلاجات الطبية "المستقبلية" الواعدة، والمتواجدة حالياً في السوق لكنه يستخدم حالياً لعلاج تضخم البروستات الحميد، وهو من إنتاج شركة غلاكسوسميث ويباع تحت الاسم التجاري (أفودارت). بشكل مشابه للفيناسترايد، فإن الدوتاسترايد هو مثبط لأنزيم مختزل 5-ألفا ويتواجد كأقراص، وقد تبين أنه يقوم بتثبيط عملية تحويل هرمون التستوستيرون في الدم إلى ثنائي هيدروتستوسترون. يمكن أن تسبب المستويات المرتفعة من ثنائي هيدروتستوستيرون في الدم على مدى العديد من السنوات تضخم غدة البروستات لدى الرجال. أيضاً يرسل ثنائي هيدروتستوستيرون إشارات في مجرى الدم لبصيلات الشعر للتقليل من نمو الشعر، مسبباً الصلع لدى الناس الذين يملكون استعداداً وراثياً حيث تكون البصيلات لديهم حساسة لثنائي هيدروتستوستيرون.
إن الحد من تركيز ثنائي الهيدروتستوستيرون في الدم يضعف الرسالة الكيميائية التي تسبب إضعاف نمو الشعر، لدرجة أنها لا تؤثر على بصيلات الشعر المستهدفة. إن الحيلة المستخدمة لتقليل مستويات ثنائي الهيدروتستوستيرون هي استخدام دواء يمنع الأنزيم مختزل 5-ألفا من تحويل التستوستيرون إلى ثنائي الهيدروتستوستيرون. في حال لم يتحول التستسوستيرون إلى ثنائي هيدروتستوستيرون، فإن رسالة ثنائي الهيدروتستوستيرون لن تذهب للخلايا في بصيلات الشعر وستكمل هذه البصيلات نموها وتعاود إنتاج شعر جديد.
هناك نمطين من أنزيم مختزل 5-ألفا الذي يحول التستوستيرون لثنائي الهيدروتستوستيرون. في حين أن الفيناسترايد يكون فعالاً لتثبيط النمط الثاني من أنزيم مختزل 5-ألفا ، فإن الدوتاسترايد يقوم بتثبيط النمط الأول من أنزيم مختزل 5-ألفا. يعطي الفيناسترايد نتائجاً بنسبة 65 -70% في تقليل ال الديهيدروتستوستيرون في دم الرجال، بينما قد أظهرالدوتاسترايد تقليلاً في تركيز ثنائي الهيدروتستوستيرون في الدم بنسبة 90% أو أكثر. من المتوقع بأن الدوتاسترايد سوف يكون أفضل بالنسبة للنساء اللاتي يعانين من تساقط الشعر من النمط الوراثي أكثر من أي دواء آخر متوافر حالياً، بالإضافة للرجال الذين لم يحصلوا على نتائج من الفيناسترايد. تعتبر الآثار الجانبية للدوتاسترايد مشابهة للآثار الجانبية للفيناسترايد. على أية حال فإن الجرعة المناسبة لعلاج تساقط الشعر الوراثي لم يتم تحديدها، والآثار الجانبية متعلقة بالجرعة.
إن الاستهداف النوعي للخلايا التي تسبب تساقط الشعر تعتبر طريقة مميزة لزيادة فعالية أدوية تساقط الشعر، وفي الوقت نفسه تقليل الآثار الجانبية. سيكون لدينا في المستقبل غسولات موضعية تطبق على فروة الرأس، سوف تثبط هذه الغسولات بشكلٍ أكبر فعالية رسالة ثنائي الهيدروتستوستيرون وتمنعها من الوصول للخلايا في بصيلات الشعر.
إن الأدوية الموجودة بشكل أقراص أو كبسولات مثل الفيناسترايد والدوتاسترايد تؤثر على مستويات ثنائي الهيدروتستوستيرون في الدم، والتي بدورها تؤثر على كمية ثتائي الهيدروتستوستيرون في نسيج فروة الرأس، أي أنها تؤثر على تركيز الديهيدروتستوستيرون في المستوى الخلوي في بصيلات الشعر.
في المستقبل، سوف نكون قادرين على استهداف مستويات ثنائي الهيدروتستوستيرون في الخلايا في بصيلات الشعر بشكلٍ أفضل، ونتيجة لذلك نحصل على حلٍ أفضل لتساقط الشعر، والتقليل من الآثار الجانبية. يمكن أن تكون أدوية تساقط الشعر المستقبل مؤلفة من شامبو أو معدلات الشعر، وهذه المنتجات سوف تصبح طريقة لمنع تساقط الشعر، تماما مثل الفلورايد في معجون الأسنان الذي يستخدم الآن لمنع تسوس الأسنان.
سوف يكون هناك أيضاً تطورات في الأدوية المستخدمة لعلاج تساقط الشعر نتيجة الأسباب الأخرى غير الوراثية. في المستقبل سوف نقوم بتطوير أدوية جديدة والتي سوف ترسل إشارات أكثر فعالية للعديد من الخلايا في بصيلات الشعر لتبدأ أو تحافظ على طور النمو وتستمر بإنتاج الشعر، حتى عندما تستقبل إشارات أخرى مثبطة، وسوف نحرز تطورات في الأدوية المستخدمة لعلاج الأمراض التي تسبب كل من تساقط الشعر الدائم والمؤقت. يطلق الأطباء اسم (الصلع الغير مؤذي لبصيلات الشعر) على الأمراض والظروف التي تسبب تساقط الشعر المؤقت، حيث لا يحدث تخريب أو إيذاء لهذه البصيلات. حيث يحدث تساقط الشعر ولكنه إما يعاود النمو بنفسه، أو بالإشارات الكيميائية الصحيحة. تعتبر الثعلبة الموضعية صلعاً غير مؤذٍ لبصيلات. حيث أن بعض مرضى الثعلبة الموضعية يحدث لديهم نمو للشعر حتى بعد سنوات من تساقط الشعر. كما أن تساقط الشعر الناتج من العلاج الكيميائي، والجرعات المعتدلة من العلاج الشعاعي، أيضاً غير مؤذٍ لبصيلات الشعر، حيث أن جسم الشعرة الذي يسحب أو يقتلع من البصيلة لا يؤذي البصيلات بشكلٍ دائم. بعد تساقط الشعر فإن بصيلات الشعر تستريح ثم تتعافى، وتنمو بصيلات شعر جديدة وتكبر وتنتج شعراً جديداً.
الصلع غير المؤذي للجريبات يؤثر على "البصيلات" وهي الجزء من جريبات الشعر، المتوضع في قاعدة الجريب عميقاً في الجلد. تقوم الخلايا المتخصصة في البصيلة بإنتاج جسم الشعر خلال 4 -6 سنوات أثناء كل دورة حياة الشعر، ولكن في نهاية دورة النمو يبدو أنها تتدهور مع جريبات الشعر وتتقلص في الحجم وتدخل في طور الراحة من دورة النمو الطبيعية. بعد ذلك تنتج خلايا البصيلات الجديدة في بداية دورة النمو المتلاحقة.
الأدوية المستقبلية التي تستهدف بشكلٍ فعال أو تحمي خلايا البصيلة يمكن أن تستخدم في علاج أكثر فعالية للثعلبة الموضعية علاوةً على تساقط الشعر الناتج عن التوتر وعلاجات السرطان.
يطلق الأطباء اسم (الصلع المؤذي لجريبات الشعر) على الصلع الناتج عن الأمراض التي تسبب تساقط الشعر ، لأن المرض يؤثر أو يؤذي جريبات الشعر وفي مثل هذه الطريقة فهي تخسر قدرتها على إنتاج شعر جديد. بعض الأمراض المؤذية للجريبات مثل الذئبة الحمامية تسبب استجابة التهابية مناعية حيث تصبح الكريات البيضاء في الجسم تهاجم الخلايا في منطقة " الانتفاخ " من جريب الشعر. تقع منطقة الانتفاخ بالقرب من منتصف بصيلة الشعر، أسفل الغدد الدهنية وبالقرب من نقطة الاتصال للعضلة النا صبة للشعر (الضلة الصغيرة التي تسمح للشعر بالارتكاز على النهاية).

الصلع الذكوري (تساقط الشعر الوراثي) يعتبر أيضاً من الأمراض المؤذية للبصيلات، حيث يقلل من إنتاج بصيلات الشعر عبر الوقت حتى لا يعود ينمو شعر جديد. تفترض الأبحاث الجديدة أن منطقة الالتهاب في أمراض تساقط الشعر الدائم هذه هي " الانتفاخ " من جريب الشعر، ويعتقد أن العديد من الخلايا في منطقة الانتفاخ مسؤولة عن عودة نمو بصيلات الشعر في بداية كل طور نمو جديد.
يعتقد أن العديد من الخلايا في الانتفاخ تقوم بانتاج الخلايا في بصيلة الشعر في بداية كل طور نمو، و تقوم هذه الخلايا بإنتاج شعر جديد. عندما تتأذى الخلايا الموجودة في منطقة الانتفاخ بشكلٍ كاف، فإن جريبات الشعر تصبح غير قادرة على إنماء بصيلات جديدة، ولا تعود ينتج أي شعر جديد. في المستقبل، الأدوية التي تحمي الخلايا في منطقة الانتفاخ سوف تعالج بشكلٍ فعال الأمراض المسببة لتساقط الشعر الدائم، بما في ذلك لتساقط الشعر الوراثي.
مستقبل العلاجات الجراحية لتساقط الشعر:
سوف تكون العلاجات الجراحية المتوافرة في أيامنا لعلاج تساقط الشعر ذات فعالية محدودة فى المستقبل حيث أنها ببساطة لا يمكنها إعطاء رأس مليء بالشعر الكثيف. النقطة الأساسية لتطوير العلاج الجراحي هي استنساخ الشعر. إن استنساخ بصيلات شعر متعددة بنجاح من البصيلات الموجودة في المنطقة المانحة للشعر والتي تكون مبرمجة بالفعل لمواصلة إنتاج شعر جديد لمدى الحياة يؤدي إلى إمدادات لا حدود لها من بصيلات الشعر التي تستخدم لزراعة الشعر، وبالتالي يمكن الحصول على غزارة شعر غير محدودة تماثل الغزارة الأصلية. سيصبح بالإمكان حتى حقن بصيلات الشعر المستنسخة بشكلٍ مباشر في فروة الرأس، والقضاء على الجراحة تماما.
إذاً، في حال كان بإمكان العلماء استنساخ أغنام كاملة، لماذا لا يصبح استنساخ الشعر البشري واقعاً؟ الجواب معقد إلى حدٍ ما، ويتطلب بعض التفسير لبيولوجيا الخلية، وعلم الوراثة، وتكاثر الخلايا، ومن ثم استعراض بعض الأنواع المختلفة من الاستنساخ التي قد تطبق في المستقبل لمضاعفة بصيلات الشعر البشري.
بيولوجيا الخلية:
الخلايا هي الوحدات الأساسية لجميع الكائنات الحية. تمتلك الخلايا في الكائنات الحية عديدة الخلايا ميزات متخصصة والتي تمكنها من القيام بعملها بأقصى قدر من الكفاءة. تعمل الخلايا الفردية في كائن حي جنباً إلى جنب مع خلايا أخرى مماثلة في النسيج، أو أنها تعمل جنباً إلى جنب مع أنواع مختلفة من الخلايا في بنى متخصصة الخلايا تسمى الأجهزة. على سبيل المثال، في جريبات الشعر، وهو جهاز مصغر، هناك عدة أنواع مختلفة من الخلايا تعمل معاً لنمو الشعر.
داخل كل خلية ناضجة يوجد بنية تسمى نواة الخلية والتي تحتوي على الكروموسومات على شكل خيطين مزدوجين من جزيئات الحمض النووي الملتوية. تحتوي جزيئات الحمض النووي على معلومات حول تكوين أنواع معينة من البروتينات، وتقوم هذه البروتينات بأدوارها الخاصة بالخلية. بعض البروتينات هيكلية، مثل بروتين الكيراتين في الشعر، في حين أن البعض الآخر لديه وظيفة إرسال الرسائل، مثل هرمون ثنائي الهيدروتستوستيرون، وبعض البروتينات مثل انزيم مختزل 5-ألفا ، تساعد على تحويل البروتينات من شكلٍ إلى آخر.
الوراثة:
تسمى جزيئات الحمض النووي التي تحتوي على رمز لأنواع معينة من البروتينات بالمورثات (الجينات). هذا هو كل شيء بالنسبة للمورثات: إنها تعليمات لصنع بروتينات محددة. لا توجد مورثات لخصائص معينة من الجسم، مثل "الصلع " أو "العيون الخضراء" أو "الشعر مجعد". فقط تعليمات لصنع البروتينات.
ولكن الأنواع المحددة من البروتينات والتي تقوم المورثات بتوجيه الخلايا لتركيبها، تقوم بتحديد خصائص معينة مثل تساقط الشعر الوراثي ولون العين وتجعد الشعر. وبالتالي فإن العديد من المورثات المختلفة، والعديد من البروتينات المختلفة، تحدد مع بعضها خصائص جسمية وراثية معينة.
هناك سمة ملحوظة للخلايا في الكائنات متعددة الخلايا هو أن كل خلية تحتوي في النواة على مخطط الحمض النووي كاملاً لجميع الجينات ولجميع بروتينات الكائن الحي بأكمله، إلا أن كل خلية تستخدم فقط معلومات صنع البروتين التي تحتاجها للقيام بعملها الخاص، بالرغم من أنها تحتوي على معلومات صنع البروتين للكائن الحي بأكمله. على سبيل المثال، الخلايا في قزحية العين قد تصنع البروتينات التي تعبر عن خصائص العين الخضراء، ولكن ليس البروتينات التي يمكن أن تسبب نمط الصلع أو الشعر المجعد، أو أياً من آلاف أخرى من الصفات الوراثية للكائن الحي، ولكن المعلومات لصنع كل تلك البروتينات موجودة في خلايا القزحية إلا أنها غير مفعّلة تماما كما أن المعلومات لصنع البروتينات التي تؤدي إلى عيون خضراء موجودة في خلايا بصيلات الشعر. فك قفل معلومات الحمض النووي في الخلايا المتخصصة المتمايزة هو جانب هام من بعض تقنيات الاستنساخ.

تكاثر الخلايا:
في الجنين الذي ينمو بسرعة، تتكاثر الخلايا عن طريق الانقسام المنصف ثم تنمو إلى الحجم الكامل مرة أخرى. وتسمى هذه العملية بالانقسام الخلوي، وكل نصف من هذه الخلية المنقسمة تحتوي على مجموعة كاملة ودقيقة من DNA الكائن الحي. عندما ينمو الجنين إلى كائن حي يعمل بشكلٍ كامل، تبدأ خلاياه في أخذ سمات أكثر تخصصاً، وتبدأ بالانقسام بشكلٍ أقل. عندما تصبح الخلايا أكثر تخصصاً، ينحصر تكاثر الخلايا بخلايا ابتدائية خاصة تسمى الخلايا الجذعية.
الخلايا المتمايزة المتخصصة لا تتضاعف بسهولة، ربما كخط دفاع ضد السرطان، والذي يتميز بانقسام الخلايا غير المنضبط. ولكن كل الخلايا تموت مع مرور الوقت، ويجب أن تحل محلها خلايا جديدة. بعض الخلايا تعيش لعدة أيام فقط، والبعض الآخر لسنوات، وغيرها لعدة عقود، ولكن في نهاية المطاف جميع الخلايا تموت. عدم قدرة الخلايا المتمايزة على تكرار نفسها يحدّ من قدرة الجسم على إصلاح نفسه، لشفاء الجروح واستبدال الخلايا الهرمة، كما أنه يجعل عملية الاستنساخ أكثر صعوبة.
في الكائنات الناضجة، هناك خلايا غير متمايزة تسمى الخلايا الجذعية هي المسؤولة عن استبدال الخلايا المتخصصة القديمة أو المتأذية. توجد الخلايا الجذعية في جميع الأنسجة ذاتية الإصلاح، ولكن معظم الخلايا الجذعية يصعب الكشف عنها في كائن حي ناضج. تعتبر الخلايا الجذعية في كائن ناضج هي مثل الخلايا الجنينية، حيث أنها يمكن أن تتحول للعديد من الأنواع المختلفة من الخلايا المتخصصة. بما أن الخلايا الجذعية ليست نشطة بإنتاج الخلايا الجديدة، فإنها تنقسم بشكلٍ غير منتظم، مما يقلل من خطر طفرات الحمض النووي الغير مرغوبة. ولكن عندما يتم توجيهها لصنع خلايا جديدة من نوع معين، فإنها تنتج عادة خلايا وسطية قصيرة الأجل تسمى خلايا تضخيم انتقالية، والتي تشارك بدورها في الانقسام الخلوي السريع وتكوين الخلايا المتخصصة التي يحتاجها الكائن الحي.
حسناً، كمراجعة سريعة، علمنا أن الخلايا تشكل الأنسجة والأعضاء، والتي بدورها تشكل الكائنات الحية. يحتوي الحمض النووي في الخلايا على الجينات والتي هي عبارة عن تعليمات لصنع البروتينات، و تحدد هذه البروتينات صفات الخلايا المتخصصة ووظائفها. الخلايا المتخصصة بدورها، تحدد خصائص الكائن الحي، بما في ذلك الخصائص الموروثة، مثل مقاومة هرمون ثنائي الهيدروتستوستيرون، على سبيل المثال. لا تتضاعف الخلايا المتخصصة بسهولة. عندما يحتاج كائن حي إلى خلايا متخصصة جديدة، يتم إرسال إشارة إلى الخلايا الجذعية لخلق خلايا تضخيم انتقالية، والتي بدورها تشكّل الخلايا المتخصصة اللازمة.
أنواع الاستنساخ:
تعتبر العلاجات الجراحية المتوافرة في أيامنا ذات فعالية محدودة لأنه لا يتم إضافة شعر جديد. وبالتالى فإن الطرق الجراحية المتبعة ببساطة لا يمكنها إعطاء رأس مليء بالشعر الكثيف. إن زراعة الشعر هى عبارة عن إعادة ترتيب لشعر المريض الموجود لديه بالأصل والموجود في المناطق الخلفية والجانبية لفروة الرأس والمقاوم للتساقط لإعطاء مظهر أكثر اكتمالاً. لكن لا يوجد إضافة شعر جديد. تحتاج الطرق الجراحية الحالية جهداً كبيراً وتعتبر مكلفة، وتتضمن خطوات مزعجة للمريض وهناك وقت لازم لإعادة الشفاء. النقطة الجوهرية لتطوير العلاج الجراحي هي استنساخ بصيلات الشعر. إن استنساخ بصيلات شعر متعددة بنجاح من البصيلات الموجودة في المنطقة المانحة للشعر والتي تكون مبرمجة بالفعل لمواصلة إنتاج شعر جديد لمدى الحياة يؤدي إلى إمدادات لا حدود لها من البصيلات التي تستخدم لزراعة الشعر، وبالتالي حصول على كثافة شعر غير محدودة تماثل كثافة الشعر الأصلية. سوف يصبح بالإمكان حتى حقن البصيلات المستنسخة بشكلٍ مباشر في فروة الرأس، والاستغناء عن الجراحة تماماً.
العلاج الجيني:
هناك تقنية أكثر تطوراً لحل مشكلة تساقط الشعر الوراثي في المستقبل هي العلاج الجيني. إن العلاج الجيني هو عملية تغيير جينات الخلايا الموجودة في الجسم، وبالتالي تغيير وظيفة الخلية. وهو علاج طبي لا يزال في مراحله الأولى، ولم يكن هناك سوى بضعة أمثلة حديثة من العلاج الجيني ولكنها طريقة محتملة لعلاج تساقط الشعر في المستقبل وتستحق الاستكشاف. يتطلب العلاج الجيني يتطلب معرفة كيفية حدوث حالة طبية موروثة على مستوى جزيء الحمض النووي، ثم تتبعها وتحديدها. مع العلاج الجيني، يمكن استبدال بصيلات الشعر الحساسة لثنائي هيدروتستوستيرون بصيلات ذات خلايا مقاومة له، وبالتالي سوف تستمر بصيلات الشعر في إنتاج شعر جديد لمدى الحياة. ولكن يتضمن العلاج الجيني العديد من الخطوات الصعبة جداً تحقيقها. الخطوة الأولى هي تحديد أي من عشرات الآلاف من المورثات على سلاسل الحمض النووي تشارك في الصفة التي يمكن تغييرها، والخطوة الثانية هي معرفة كيفية إمكانية تغيير المورثات المستهدفة بالضبط، بحيث تعطي تعليمات لتركيب بروتينات مختلفة قليلاً من شأنها أن تحقق التأثير المطلوب. الخطوة الثالثة هي الحصول على الخلايا المستهدفة في الكائن الحي لدمج المورثات الجديدة والمحسنة كبديل للجينات القديمة والغير المرغوب بها.
تعريف المورثات:
إن معرفة المورثات التي تشارك في الحالة الجينية التي يجب تغييرها ليست مهمةً سهلة. على الرغم من كل التقدم في رسم الخرائط الجينية في السنوات الأخيرة، فما زلنا بعيدين جداً عن معرفة وظيفة معظم هذه المورثات. بالتأكيد نحن لا نملك فهماً جيداً لجميع المورثات التي تؤثر على دورة حياة الشعر، وخاصة المورثات المسؤولة عن تساقط الشعر الوراثي. ومن المرجح أن العديد من المورثات هي المسؤولة عن صنع البروتينات التي تجعل العديد من بصيلات الشعر حساسة لثنائي هيدروتستوستيرون. من المرجح أن تشمل الدراسات المستقبلية مقارنة المورثات والبروتينات الناتجة في بصيلات مختلفة من فرد واحد. لدى شخص معين مصاب بالصلع الذكوري (نمط تساقط الشعر)، سوف تعبر بعض خلايا بصيلات الشعر عن سمة المقاومة لثنائي الهيدروتستوستيرون (البصيلات في الجزء الخلفي من فروة الرأس)، في حين أن بصيلات الشعر الأخرى في نفس الشخص سوف تعبر عن سمة الحساسية تجاه لثنائي الهيدروتستوستيرون (في خط الشعر الأمامي الجبهي، على سبيل المثال).
تحتوي كلا البصيلات على خلايا ذات محتوى متطابق من الحمض النووي، لكنها تعبر عن خصائص مختلفة. لذا فإن تحديد المورثات المسؤولة سيكون صعباً. وحتى بعد تحديد هذه المورثات، علينا أن نعرف كيفية تغييرها حتى يصبح بإمكانها إنتاج البروتينات التي تجعل بصيلات الشعر مقاومة لثنائي الهيدروتستوستيرون، إلا أن العلماء قد أحرزوا تقدما في تحديد هذه المورثات.
تغيير المورثات في الخلايا الحية والكائنات الحية:
التحدي الثالث من العلاج الجيني هو تقديم المورثات الجديدة والمحسنة إلى الخلايا المستهدفة، بعد ذلك سوف تستخدم تلك الخلايا المورثات الجديدة لصنع البروتينات الجديدة المقابلة، وفي النهاية سوف تعبر هذه الخلايا المعدلة عن السمة المطلوبة.
إن اختيار الخلايا المستهدفة الصحيحة هي نقطة حاسمة لنجاح العلاج الجيني. إذا تم تعديل الخلايا المتمايزة، ستزول فوائد العلاج الجيني بعد موت تلك الخلايا ويتم استبدالها بخلايا جديدة تحتوي على الحمض النووي الأصلي. للحصول على تأثير طويل الأمد، يجب استهداف الخلايا الجذعية. عندما تكون ناجحة، فإن الخلايا الجذعية المعدّلة سوف تقوم بتشكيل خلايا تضخيم انتقالية معدلة، والتي بدورها سوف تكوّن الخلايا المتخصصة المعدلة التي سوف تعبر عن الخصائص المطلوبة.
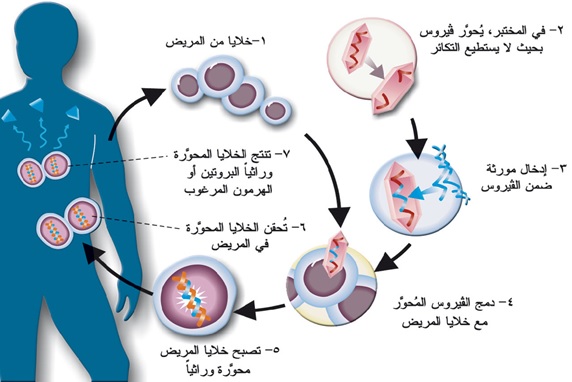
الطريقة الأكثر شيوعاً لإيصال المورثات المعدلة تشمل استخدام الفيروسات المضعفة لإدراج المورثات المطلوبة في الخلايا المستهدفة. خارج المختبر، الفيروسات هي عبارة عن كائنات صغيرة تصيب الخلايا عن طريق استبدال جزء من الحمض النووي للخلايا المضيفة بالحمض النووي الفيروسي. بعد العدوى بفيروس ما، تبدأ الخلية بصناعة البروتينات التي يطلبها الحمض النووي الفيروسي، مما يسبب في التعبير عن أمراض مختلفة. يستخدم العلماء آلية العدوى الفيروسية لتوصيل الحمض النووي المرغوب فيه.
في البداية، يتم إضعاف الحمض النووي الفيروسي بحيث لا يمكنه أن يتكاثر أو يسبب آثاراً ضارة، ولكنه لا يزال قادراً على إدراج الحمض النووي الجديد في الخلايا المستهدفة، ويتم ربط المورثات المطلوبة بالحمض النووي الفيروسي، وتقوم الفيروسات بإدخال الحمض النووي الجديد في الخلايا المستهدفة.
يمكن حقن الفيروسات مباشرة إلى الموقع حيث توجد الخلايا الجذعية، أو يمكن زراعة الخلايا الجذعية في المختبر، وتعديلها من قبل الفيروسات التي تحتوي على الحمض النووي الجديد، ثم يتم إعادة الخلايا الجذعية المعدلة مرةً أخرى إلى الكائن الحي.
هناك العديد من مجالات العلاج الجيني التي تحتاج إلى مزيد من البحث. تحديد المورثات، تحديد كيفية تغييرها بالضبط لتصبح تعبر عن البروتينات المطلوبة، وتجنب الاستجابة المناعية عندما يتم حقن الفيروسات مباشرة في الكائن الحي، والحصول على كمية كافية من الخلايا المستهدفة لالتقاط الحمض النووي المعدل بغض النظر عن كيفية توصيلها، والحصول على الخلايا التي تعبر عن الخصائص المشفرة من قبل المورثات المعدلة بمجرد إدخال الحمض النووي الجديد، كل هذه النقاط تحتاج إلى مزيد من العمل والبحث، لكن يتم المضي قدماً في هذا المجال.
خلاصة القول، فإن مستقبل علاج تساقط الشعر واعداً جداً، ابتداءً من الأدوية الجديدة مثل الدوتاسترايد إلى التقدم في استنساخ الشعر والعلاج الجيني. ولكن العديد من هذه العلاجات تحتاج لسنوات، وربما لعقود حتى تدخل حيز الاستخدام. لكن هناك طرق للعلاج حالياً مثل منتجات التجميل، والأدوية مثل الفيناسترايد، والإجراءات الجراحية مثل زراعة الشعر متوفرة الآن، إذا كنت تريد حقاً أن تقاوم حالة الصلع أو تساقط الشعر التي تواجهك. يجب أن تكون أول خطوة تقوم بها هي الاستشارة الطبية لتقييم حالتك والقيام بما يتطلبه ذلك.